新闻动态
可见光和紫外光谱
可见光和紫外光谱
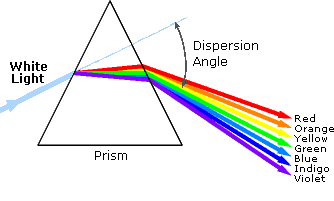
1.背景
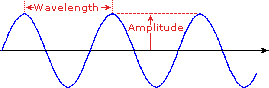
某些化合物之间的明显区别是它们的颜色。因此,醌是黄色的; 叶绿素是绿色的; 醛和酮的2,4-二硝基苯腙衍生物的颜色从亮黄到深红色,这取决于双键共轭; 阿司匹林是无色的。在这方面,人眼起分光器的作用,分析从固体表面反射的光或通过液体。尽管我们看到日光(或白光)在颜色上是均匀的或均匀的,但实际上是由光谱的紫外(UV),可见光和红外(IR)部分中的各种辐射波长组成的。如右图所示,可见光部分的组件颜色可以通过使太阳光穿过棱镜来分开,棱镜用于根据波长以不同的角度弯曲光线。波长在左下方定义为相邻波峰(或波谷)之间的距离,可以用米,厘米或纳米(10-9米)表示。频率是每单位时间经过固定点的波形周期数,通常以每秒周期数或赫兹(Hz)表示。可见波长范围从400到800纳米左右。极长的可见波长是红色,极短的是紫色。其他常见的光谱颜色,按波长递减的顺序,可以通过助记符来记住:ROY G BIV。在光谱的可见部分中我们认为是特定颜色的波长被显示并在下面列出。在水平图中,例如左下角的图,从左到右移动时,波长将会增加。
 |
|
 |

当白光通过或被有色物质反射时,混合波长的特征部分被吸收。其余的光线将呈现与所吸收的波长互补的颜色。这种关系由右侧显示的色轮表示。这里,互补色彼此完全相反。因此,420-430纳米的光吸收使物质变黄,500-520纳米的光吸收使其变红。绿色是独特的,它可以通过接近400nm的吸收以及在800nm附近的吸收来产生。
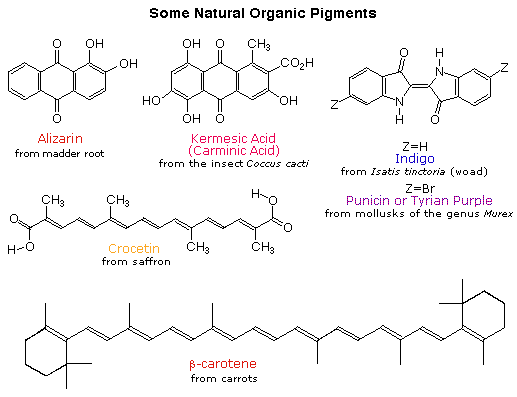
早期人类重视有色颜料,并将其用于装饰目的。其中许多是无机矿物质,但几种重要的有机染料也是已知的。这些包括深红颜料,蛋白质酸,蓝色染料,靛蓝和黄色藏红花色素,西番莲。一种罕见的二溴靛蓝衍生物,石棉,被用来着色皇室和富裕的长袍。深橙色碳氢化合物胡萝卜素广泛分布于植物中,但不足以作为永久性颜料使用,除了食用色素。下面显示的所有这些有色化合物的共同特征是广泛地共轭π电子的体系。
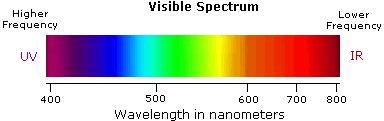
2.电磁频谱
可见光谱只占总辐射光谱的一小部分。我们周围的大部分辐射都看不到,但是可以通过专用的感测仪器来检测。这种电磁波谱范围从非常短的波长(包括伽马和X射线)到非常长的波长(包括微波和广播无线电波)。下图显示了该光谱的许多重要区域,并展示了波长和频率之间的反比关系(如图表下方的顶部公式所示)。
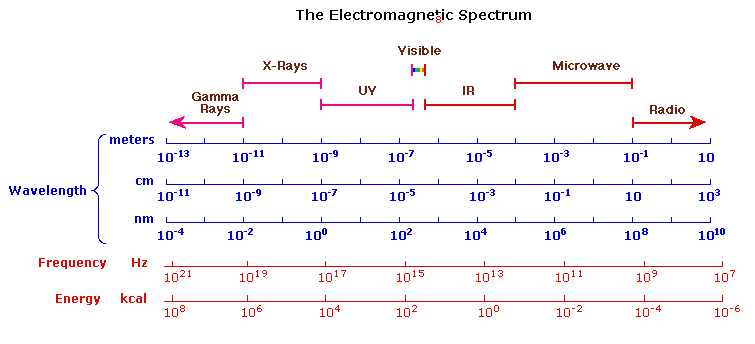
与给定的频谱段相关的能量与其频率成比例。底部方程式描述了这种关系,它提供了给定波长的辐射光子携带的能量。
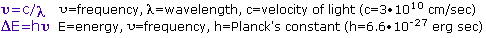
为了获得特定的频率,波长和能量值使用这个计算器。
3.紫外可见吸收光谱
为了理解为什么某些化合物是有色的,而其他化合物是没有色彩的,为了确定与色彩的共轭关系,我们必须准确测量光谱可见部分和其附近不同波长处的光吸收。商用光谱仪使这样的实验能够轻松进行,并且通常对光谱的近紫外和可见部分进行测量。
光谱的可见区域包括36至72千卡/摩尔的光子能量,并且近200至200nm的近紫外区域将该能量范围扩展至143千卡/摩尔。波长小于200nm的紫外线难以处理,很少用作结构分析的常规工具。
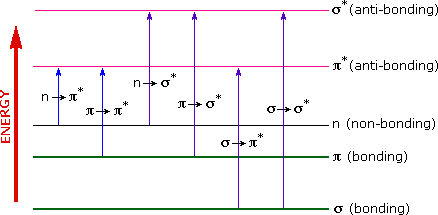
上面提到的能量足以促进或激发分子电子到更高的能量轨道。因此,在这个区域进行的吸收光谱有时被称为“电子光谱”。左图显示了在有机分子中可能出现的各种电子激发的图表。在概括的六个转换中,只有极低能量的两个(极左端的,蓝色的)是通过200-800nm谱中的能量获得的。一般来说,有利于电子促进的是从极高占据分子轨道(HOMO)到极低未占分子轨道(LUMO),所得到的物质被称为激发态。有关分子轨道的综述点击这里。
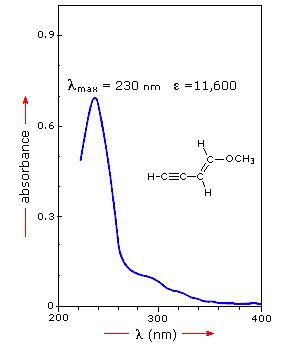
当样品分子暴露在能量与分子内可能的电子跃迁相匹配的光线中时,一些光能将被吸收,因为电子被提升到更高的能量轨道。光谱仪记录发生吸收的波长,以及每个波长的吸收程度。如下面所示的异戊二烯光谱中所得到的光谱以吸光度(A)对波长的图表表示。由于异戊二烯是无色的,因此在光谱的可见部分不吸收,并且该区域不显示在图上。吸光度通常从0(无吸收)到2(99%吸收)范围内变化,并在光谱仪操作的背景下进行精确定义。
由于样品的吸光度与光谱仪光束中吸收分子的数量成正比(例如样品管中的摩尔浓度),因此如果不同的光谱具有不同的吸光度值化合物将以有意义的方式进行比较。校正的吸收值称为“摩尔吸收率”,在比较不同化合物的光谱和确定光吸收函数(发色团)的相对强度时特别有用。摩尔吸光系数(ε)定义为:
|
摩尔吸光系数ε= A / cl |
(其中A =吸光度,c =样品浓度(摩尔/升),l =通过样品的光路长度,cm) |
|---|
如果右边的异戊二烯光谱由1cm样品杯中的稀己烷溶液(c = 4×10 -5摩尔/升)获得,则使用上式的简单计算表明在极大吸收下摩尔吸收率为20,000波长。实际上,一旦关于样品的这个信息在手,那么整个垂直吸光度标度可以改变为摩尔吸光度标度。点击谱图将以单位显示这个变化。
|
 |
从上面的图表应该清楚,在200-800nm区域中可能吸收光的唯一分子部分是π电子函数和具有非键合价电子壳层电子对的杂原子。这种光吸收基团被称为发色团。左上方提供了一些简单的发色团及其吸光特性的列表。醇和醚中的氧非键合电子不会引起160nm以上的吸收。因此,纯的醇和醚溶剂可用于光谱研究。
分子中存在的发色团极好通过紫外 - 可见光谱记录,但大多数仪器不能提供低于200nm波长的吸收数据,使得检测分离的发色团成为问题。幸运的是,共轭通常将吸收极大值移动到较长的波长,如异戊二烯的情况,所以共轭成为由该技术确定的主要结构特征。
如果吸收很弱(10-100),摩尔吸光率对于强吸收发色团可能非常大(> 10,000),而非常小。ε的大小反映了发色团的大小和给定波长的光在撞击发色团时被吸收的概率。
4.共轭的重要性
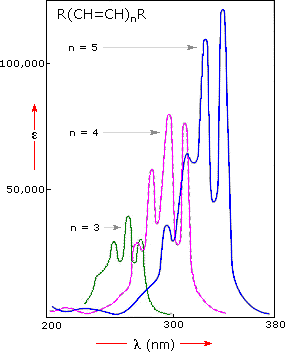
1-戊烯吸收光谱的比较,λmax= 178nm,异戊二烯(上图)清楚地表明发色团缀合的重要性。下面显示了这种效应的进一步证据。左边的光谱说明双键和三键的共轭也将吸收极大值移到较长的波长。从中心图中显示的多烯谱中可以清楚地看出,共轭π电子体系中每个额外的双键在同一方向上将吸收极大值偏移约30nm。另外,摩尔吸光系数(ε)大致上是每个新的共轭双键的两倍。当描述吸收的变化时,光谱学家使用右表中定义的术语。因此,扩展共轭通常导致吸收的红移和深色移。
给定发色团的几个吸收峰或肩的出现对于高度共轭体系是常见的,并且通常是溶剂依赖性的。这种精细的结构不仅反映了这种系统可能承担的不同构象,而且还反映了每个电子状态可能的不同振动能级之间的电子转换。这种振动精细结构在气相光谱中极为显着,并且随着溶剂从己烷变为甲醇,在溶液中变得越来越宽并且变得模糊。
 |
 |
吸收转移的术语
|
|---|
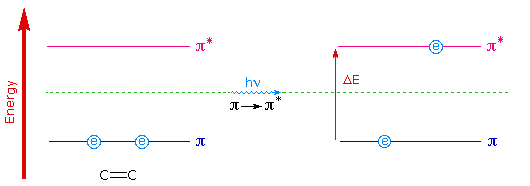
为了理解为什么共轭应该引起发色团吸收极大值的红移,我们需要看一下π-轨道的相对能级。当两个双键共轭时,四个p-原子轨道结合生成四个π-分子轨道(两个键合,两个反键合)。这在前面关于二烯化学的部分已经描述过了。以类似的方式,共轭三烯的三个双键形成六个π-分子轨道,半键键和半键键。能量上极有利的π __ > π*激发从极高能量接合的π轨道(发生HOMO)与极低能量反键的π轨道(LUMO)。
下图说明了分离的双键(只有两个π-轨道)的激发,点击图上的共轭二烯和三烯。在每种情况下,HOMO都是蓝色,而LUMO则是有色的洋红色。增加的共轭使HOMO和LUMO轨道更接近。实现电子促进所需的能量(ΔE)因此较小,并且提供这种能量的波长相应地增加(记住 λ= h · c /ΔE)。
 |
|
π __ > π*激励的例子 |
|---|
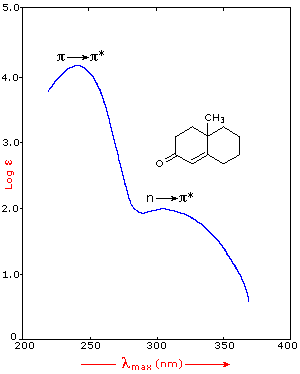
许多其他种类的共轭π电子体系作为发色团并吸收200-800nm区域的光。这些包括不饱和的醛和酮以及芳香环化合物。下面显示了一些例子。不饱和酮的光谱(左图)显示了摩尔吸光度的对数显示的优点。 位于242nm处的π _- > π*吸收非常强,ε= 18,000。所述弱n __ > π* 300nm附近具有ε= 100吸收。
 |
 |
|---|
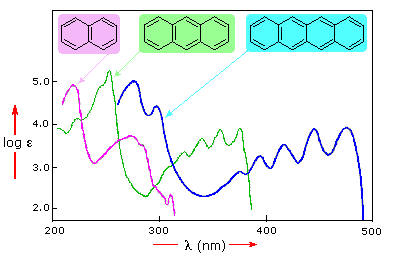
苯在180nm(ε> 65,000)附近具有非常强的光吸收,在200nm(ε= 8,000)具有较弱的吸收,在254nm(ε= 240)具有较弱的一组。由于大多数分光测色仪的200 nm截止特性,只有极后一组吸光度才能完全显示。在萘,蒽和并四苯中加入的缀合物引起这些吸收带的红移,如左下图所示。所有的吸收都不会发生相同的变化,因此对于蒽(绿色阴影框)和并四苯(蓝色阴影框),弱吸收被更强的红移遮挡。从他们的光谱可以预料,萘和蒽是无色的,但是并四苯是橙色的。
 |
 |
|---|
双环二烯(右上)的光谱显示出一些振动的精细结构,但是通常在外观上与上面所示的异戊二烯类似。更仔细的检查公开了更高度取代的二烯的极大吸收已经移动到更长的波长大约15nm。这种“取代基效应”对于二烯和三烯是通用的,并且对于烯酮发色团更为显着。

